Células Natural Killer e Vigilância Imunológica
CÉLULAS NATURAL KILLER E VIGILÂNCIA IMUNOLÓGICA
Artigo científico desenvolvido pelos autores: Mariana Jobim e Luiz Fernando Jobim
Resumo
Objetivos: Analisar a importância das células Natural Killer (NK), de seus receptores KIRs (killer immunoglobulin-like receptors) e correspondentes genes na vigilância imunológica do organismo contra agentes infecciosos, transplantes de células-tronco hematopoiéticas, assim como sua participação na auto-imunidade. As características, a nomenclatura e o polimorfismo dos genes e receptores KIR na população brasileira serão identificados.
Síntese de Dados: Identificamos o perfil de genes e haplótipos KIR na população caucasóide brasileira, sendo de importância esse conhecimento para a análise da relação desse sistema com doenças. Examinamos 116 indivíduos doadores voluntários de medula óssea, identificando-se 32 genótipos e a presença de 51% e 49% de haplótipos A e B respectivamente. Foi realizado estudo comparativo entre os nossos genótipos e os de outras populações.
Conclusões: A imunidade inata é uma barreira anti-infecciosa de importância em Pediatria, tendo sido pouco estudada no passado recente. Ela atua de maneira independente da imunidade celular e humoral, sendo mais rápida que as demais fontes de proteção do organismo. Ao mesmo tempo, ela estimula os linfócitos T CD8 a agirem e amplificarem a rede de proteção imunológica. Entretanto, como na maioria das vezes que a imunidade atua, ela também pode ser prejudicial, agredindo o organismo por mecanismos auto-imunes ou mesmo, na sua ausência, oferecer espaço aos agentes infecciosos para agirem de forma impune.
Palavras chaves: KIR genes; Natural Killer cells; KIR genotypes in brazilian caucasoids.
Introdução
O sistema imunológico é uma rede de componentes celulares e humorais com função de discriminar o “próprio do não-próprio”, procurando eliminar os agentes infecciosos, as células tumorais e as transplantadas.
As células Natural Killer (NK) são importantes nessa vigilância imunológica. Fazem parte da imunidade inata e correspondem a cerca de 10 a 20% dos linfócitos circulantes. Morfologicamente são maiores do que os linfócitos T e B, apresentando citoplasma granular e marcadores de superfície CD16 e CD56. Diferem funcionalmente dos integrantes da imunidade adaptativa por reagirem de maneira rápida, talvez em poucas horas, durante a invasão do organismo por vírus e bactérias. Ao contrário, os linfócitos T podem levar dias até iniciarem a resposta imune efetiva, embora apresentem muito em comum com as células NK, especialmente pela presença de marcadores de superfície, função efetora citotóxica por intermédio de secreção de citoquinas, perforinas, granzimas, interferon gama e relação estreita com as células dendríticas (CD). As células NK apresentam algumas diferenças como a ausência do receptor de célula T (TCR), molécula central da resposta imunológica do linfócito T e que necessita de experiência tímica para ganhar a circulação e mostrar efetividade na vigilância do organismo1. As células NK são timo-independentes e os pacientes com ausência das NK sofrem de infecções virais persistentes, particularmente de vírus do tipo herpes. Nessa situação esses agentes só podem ser eliminados com a ação de drogas antivirais, embora apresentem resposta imune adaptativa2.
As células NK quando são isoladas do sangue podem destruir alguns tipos de células alvo. Esse nível basal aumenta de 20 a 100 vezes pela exposição ao interferon α (INF- α), interferon β (INF- β) e IL-12 produzidos por macrófagos em resposta aos agentes virais. Essas linfocinas podem ativar as NK a destruírem os agentes infecciosos imediatamente ou agirem até que os linfócitos T CD8 iniciem sua ação. O INF- α e o INF- β favorecem os efeitos citotóxicos das NK, enquanto a IL-12 estimula a produção de citocinas, entre elas o INF-γ, criando um processo de reativação positiva que ativa ambas as células no tecido infectado. Dessa maneira, as células NK são preponderantes no início da infecção no que tange à produção de INF- γ, ativando os macrófagos a secretarem linfocinas que iniciam a resposta imune adaptativa com a chegada dos linfócitos T. Quando esses assumem suas funções as células NK podem diminuir a sua função pela produção de IL-10 por parte dos linfócitos T2.
As células NK apresentam diversos receptores de superfície, também presentes em alguns linfócitos T e responsáveis pela identificação de agentes infecciosos e de células transformadas. A participação nesse processo de moléculas de classe I do complexo principal de histocompatibilidade, em especial as moléculas do sistema HLA (antígenos leucocitários humanos), foi fundamental para o entendimento da função da célula NK3. Essas mesmas moléculas HLA também são de grande importância no reconhecimento antigênico por parte dos linfócitos T, entretanto de maneira diversa do que acontece nas NK. Os linfócitos T reconhecem os peptídeos antigênicos que emergem na superfície das moléculas HLA por intermédio dos receptores TCR, sendo que a partir desse momento acontece a ativação linfocitária com produção de linfocinas e sinais estímulatórios para outras células do sistema imunológico. Já as células NK reconhecem as células infectadas, transformadas ou transplantadas pela “ausência ou presença” das moléculas HLA em sua superfície. Dessa maneira, devemos compreender o sistema HLA como assistente de dois importantes “mestres” na defesa e vigilância imunológica: a célula NK da resposta imune inata e o linfócito citolítico T da resposta imune adaptativa.
Nesse momento, devemos mencionar a hipótese da “perda de expressão do próprio” (missing self), ou seja, da diminuição da expressão ou mesmo da ausência de moléculas HLA em células infectadas, em células tumorais ou mesmo em células transplantadas com HLA estranho ou diferente, para que as células NK sejam ativadas e tornem-se agressivas e potencialmente destruidoras4,5. Dessa maneira, a vigilância imunológica por parte das células NK depende da apropriada e específica concentração de moléculas HLA na superfície de outras células alvos. Por outro lado, as células normais do organismo que apresentam níveis normais de moléculas HLA em sua superfície são reconhecidas pelas NK que geram um sinal inibidor, prevenindo a destruição do alvo6.
Hoje aceitamos que as células NK podem ser ativadas e tornarem-se citotóxicas também pela expressão exagerada de ligantes para receptores de ativação na superfície da célula alvo5. Dessa maneira, a vigilância imunológica pode ser realizada pelas NK, tanto pela expressão diminuída ou ausente de moléculas HLA nas células alvo, quanto por distúrbio do equilíbrio entre sinais ativadores e inibitórios mediados por receptores existentes nas células NK e conhecidos como KIRs (killer immunoglobulin-like receptors). Essas moléculas protéicas de importância na destruição de células anormais são a expressão de um grupo de genes identificados como genes KIR (killer immunoglobulin-like receptors genes).
A imunidade inata e as células NK são de grande importância em Pediatria. Muitas doenças infecciosas são combatidas efetivamente, enquanto o sistema imune adaptativo ainda não estiver definitivamente desenvolvido. Em certas doenças que se apresentam com regulação anormal da expressão HLA na superfície celular – como infecções virais e tumores – a falta de sinal inibidor, além de prevenir a inibição propriamente dita, permite a ativação das células NK7,8. Por outro lado, existem doenças auto-imunes que são influenciadas pela ativação e inibição das células NK, assim como pacientes podem ser protegidos por esse sistema inato após um transplante de medula óssea (TMO) para tratamento de leucemia (Figura 1).

Figura 1 – Relações entre célula NK e célula Alvo, de acordo com a presença ou ausência de ligantes HLA
Nomenclatura e polimorfismo dos receptores e genes KIR
As células NK circulam no sangue num estado praticamente ativado, preparadas para entrar no tecido infectado quando os macrófagos soarem o alarme. Para manter as NK nesse estado, existe um sistema de receptores que liberam sinais de ativação ou de inibição8.
A nomenclatura dos receptores das células NK está baseada na sua estrutura protéica extra e intracelular (Figura 2). Essas moléculas apresentam-se semelhantes às imunoglobulinas com dois ou três domínios extracelulares (2D e 3 D) usados para ligarem-se a determinantes polimórficos do sistema HLA-A, B e C, uma porção transmembrana (TM) e uma cauda intracitoplasmática (CIT) que pode ser curta (S ou short) e longa (L ou long). Os nomes usados para os KIRs e as seqüências de seus respectivos genes e alelos podem ser acessados no banco de dados KIR (http://www.ebi.ac.uk/ipd/kir).
As porções CIT e transmembrana predizem à atividade funcional. As com caudas curtas (C) são ativadoras e as longas (L) são inibidoras (excetuando-se o KIR2DL4). As moléculas com cauda longa apresentam um ou dois imuno-receptores com características inibitórias baseadas em tirosina (ITIM ou tyrosine-based inhibitory motifs). Em contraste, os receptores de cauda curta (S) não possuem ITIM, mas sim um aminoácido positivamente carregado na porção transmembrana que permite associação com a molécula acessória, DAP-12, liberando um sinal ativador por intermédio de imuno-receptores ativadores baseados em tirosina (ITAM). Logo, um receptor como o KIR2DS1 significa ser uma molécula composta de dois domínios extracelulares e uma única cauda intracitoplasmática “curta e ativadora”.

Figura 2 – Receptores KIR inseridos na membrana celular (MC). Os KIR podem apresentar dois ou três domínios extracelulares (D0, D1 e D2), assim como caudas intracitoplasmáticas curtas (C ou Short) ou longas (L ou Long). Essas últimas definem se a molécula é ativadora (C) ou inibidora (L).
A família de genes KIR consiste de quinze genes (KIR2DL1, KIR2DL2, KIR2DL3, KIR2DL4, KIR2DL5A, KIR2DL5B, KIR2DS1, KIR2DS2, KIR2DS3, KIR2DS4, KIR2DS5, KIR3DL1, KIR3DL2, KIR3DL3 e KIR3DS1), assim como dois pseudogenes (KIR2DP1 e KIR3DP1), localizados numa região cerca de 150 Kb do Complexo de Receptores Leucocitários (LCR) no cromossomo 19q13.4. Os genes KIR apresentam grande similaridade molecular entre si e são derivados de um gene ancestral por uma série de duplicações, recombinações e mutações. A estrutura básica dos genes KIR é de uma unidade de nove exons que representa o gene ancestral9.
Mais de 100 genótipos diferentes foram encontrados em estudo de colaboração internacional10. Encontramos 32 genótipos em 116 indivíduos caucasóides brasileiros, sendo que os dois mais comuns apresentaram a freqüência de 24 % e 13,80 % (Figura 3). Esses mesmos genótipos foram também os mais prevalentes no estudo colaborativo10

Figura 3 – Frequência de genótipos KIR na população caucasóide brasileira. Pode-se observar que 24,10% apresentam o haplótipo AA em homozigose.
Os genes KIR são herdados em bloco ou em haplótipos, assim como os genes HLA. Embora exista um grande número de haplótipos KIR, alguns são mais prevalentes, entre eles os haplótipos A e o B (Figura 4). O haplótipo A apresenta sete locos e tem como característica uma maior expressão de genes ou receptores inibitórios. Ele define-se pela presença de KIR2DL1, KIR2DL3, KIR2DL4, KIR2DS4, KIR3DL1, KIR3DL2 e KIR3DL3. O único receptor estimulatório no haplótipo A é o KIR2DS4. No haplótipo B existem inúmeras combinações de KIR2DS1, KIR2DS2, KIR2DS3, KIR2DS5, KIR3DS1 e KIR2DS4. O haplótipo B possui mais genes ativadores, sendo definido pela presença do KIR2DL2 e ausência do KIR3DL1 e KIR2DL311,12. Os genes KIR2DL4, KIR3DP1, KIR3DL2 e KIR3DL3 estão presentes em ambos haplótipos, sendo chamados de genes estruturais ou de “moldura” (framework). Em alguns haplótipos podemos observar a falta de algum gene “moldura”13.
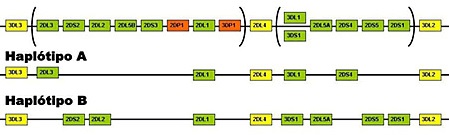
Figura 4 – Genes KIR Haplótipos A e B
Estudos sugerem que a reatividade da célula NK contra outras células do organismo não acontece em situação normal. Dessa maneira, as células NK que não expressam receptores inibitórios que reconheceriam HLA próprios são pouco responsivas e relativamente tolerantes com as células autólogas13. A expressão KIR é restrita às células NK e algumas células T, conhecidas como NKT.
Receptores ligantes das células NK
Os ligantes para os receptores KIR são as moléculas HLA de classe I (HLA-A, B e C). Os receptores KIRD2DL2, KIRD2DL3 e KIRD2DS3 reconhecem algumas das moléculas HLA-C, identificadas como pertencentes ao grupo 1 (HLA-C1). Em contrapartida, os receptores KIR2DL1 e KIR2DS1 reconhecem o grupo 2 (HLA-C2). Os grupos 1 e 2 são distinguidos por um dimorfismo na posição 80 na hélice α1 da molécula HLA-C14. As duas formas são caracterizadas pela presença de Ser77/Asn80 e Asn77/Lys80, existindo certa hierarquia na interação do KIR com moléculas HLA-C, sendo a ligação KIR2DL1-C2 mais forte do que a KIR2DL3-C1 (Tabela 1).

Tabela 1 – Receptores KIR e seus ligantes HLA-C específicos
Em um transplante de medula óssea, as células NK do doador que expressam somente receptores para o grupo C2 podem lisar células alvos homozigotas do grupo C1 do paciente. O mesmo pode acontecer caso o doador seja homozigoto para o C2 e o receptor homozigoto para C1.
O loco HLA-B, assim como o HLA-C pode ser dividido em dois grupos, Bw4 e Bw6. O KIR3DL1 interage com moléculas HLA-B quando sorologicamente forem Bw4, sendo que se essas apresentarem isoleucina (Ile) na posição 80 acontece a maior inibição de lise mediada pela célula NK. Não se conhecem interações de alta afinidade com moléculas Bw615. A molécula KIR2DL4 liga-se com HLA-G, tipo não clássico de HLA, com pouco polimorfismo e expresso em células endoteliais do timo, de trofoblastos fetais e córnea. As células NK em repouso podem ser estimuladas a produzir citoquinas e quimiocinas por HLA-G solúvel. O KIR2DL4 é um gene estrutural ou de “moldura” presente em quase todos os indivíduos, entretanto não se expressa em cerca de 50% das pessoas, sugerindo que esse gene pode estar sujeito a algum tipo de seleção. Dessa maneira, se assumimos que a interação KIR2DL4-HLA-G é fisiologicamente relevante, é possível também supor que a presença de alelos que não se expressam é decorrente de algum tipo de desvantagem em alguma circunstância.
É importante assinalar que as interações entre o KIR e seus ligantes HLA podem ser alterados por peptídeos localizados na região de ligação com as moléculas receptoras de células T. Chama atenção a interação do KIR3DL2 com HLA-A3 e A11.
Identificação Laboratorial dos Genes KIR
As amostras de sangue/EDTA para estudo de polimorfismo dos genes KIR em nossa população foram colhidas e o DNA extraído usando o procedimento de “salting-out”16. As amostras de DNA foram avaliadas usando o método de PCR-SSP para 15 genes KIR.
A seqüência dos “primers” para a reação de PCR foi baseada em publicações anteriores17. A amplificação do DNA foi realizada no instrumento Gene Amp PCR 9700 (ABI, USA). Os produtos de amplificação foram visualizados por intermédio de um transiluminador com luz ultravioleta, após eletroforese em gel de agarose a 1%, contendo brometo de etídio.
A tipagem dos genes KIR por PCR-SSO (oligonucleotídios de sequência-específica) foi realizada com os reagentes LabtypeSSO® (Teppnel-USA). A genotipagem dos alelos do sistema HLA-Cw foi também realizada usando a técnica de PCR-SSP com “primers” específicos18.
A comparação dos resultados obtidos pelos dois métodos (PCR-SSO e PCR-SSP) foi realizada pela análise de 116 indivíduos caucasóides, doadores voluntários de medula óssea (controles). Os resultados foram absolutamente idênticos, não se observando diferenças entre os dois métodos (Figura 5).

Figura 5 – Tipagem dos genes KIR por SSP-PCR. A banda controle identifica o controle externo e a banda específica, cada alelo KIR identificado por transiluminador em gel de agarose com brometo de etídeo.
Polimorfismo dos genes KIR na população caucasóide brasileira
A freqüência dos genes KIR de nossa população foi comparada com outras populações19-24. A população caucasóide brasileira, inglesa e argentina apresentam freqüências semelhantes dos genes KIR. Diferenças significativas existem em populações indígenas da Argentina, México e Brasil, quando comparadas com caucasóides. Em especial, no gene ativador KIR2DS3, pois ou não apresentam esse alelo, ou o exibem em baixa freqüência, acompanhando algumas populações orientais (Chineses e Japoneses) com KIR2DS3 de freqüência intermediária entre as populações caucasóides e indígenas sul-americanas, contrastando com os 81% encontrados nos aborígenes Australianos (Tabela 2). Outras diferenças existem em relação a outras populações, demonstrando o polimorfismo genético existente para esses marcadores e antecipando diferenças de resposta imune entre populações.
Os haplótipos A e B estão distribuídos com semelhança em Caucasóides11,12. Examinamos 116 indivíduos caucasóides brasileiros doadores voluntários de medula óssea, encontrando-se 51% e 49% de haplótipos A e B, respectivamente.
Um aspecto de interesse é a diferença entre a freqüência de haplótipos entre algumas populações. Como exemplo, podemos apontar à presença do haplótipo A em média de 75% em Japoneses, Chineses Han e Koreanos e em somente 13% nos aborígenes Australianos23-,25.
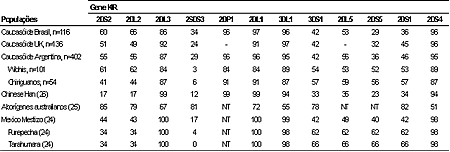
Tabela 2 – Distribuição dos genes KIR em caucasóides brasileiros e em outras populações
KIR e Doenças
A diversidade de freqüências dos haplótipos KIR e HLA em certas populações indica-nos que alguns indivíduos devem apresentar níveis diferentes de proteção contra algumas doenças.
A análise de mRNA e expressão de proteínas demonstram que cada clone de célula NK de um indivíduo não expressa todo o conjunto de genes KIR identificados em seu genoma, mas uma combinação randômica dos mesmos. Dessa maneira, cada indivíduo possui um repertório de diversas células NK com expressão variável de moléculas KIR em sua superfície26.
Alguns autores propõem um modelo de classificação das combinações KIR/HLA em termos de previsão de tendência ativadora e inibidora das células NK27,28. Num extremo do espectro estão os haplótipos AA, com a sua tendência inibidora, enquanto na outra ponta estão os haplótipos BB, com sua herança de tendência à ativação. Os genótipos com receptores inibitórios e falta de ligantes HLA predizem aumento de ativação, com poucas células NK sobre controle de inibição. Esse modelo parece ser válido para análise de risco de doença, mas necessitamos de maiores evidências de sua existência. Por outro lado, qualquer modelo que se desejar organizar para o entendimento das relações dos genótipos KIR/HLA deve levar em consideração que alguns indivíduos apresentam variantes truncadas de KIR2DS4 e KIR2DL4 no haplótipo A, não expressando moléculas KIR ativadoras na superfície de suas células NK. Mesmo assim, aparentemente tem imunidade inata normal. De acordo com esses estudos, a hipótese de que ao menos um receptor estimulatório deva existir, passa a não ser aplicável para as células NK. Além disso, as NK que não expressam receptores inibidores que reconheçam o HLA próprio (self), aparentemente são pouco responsivas e relativamente tolerantes às células autólogas. O mecanismo responsável por esse efeito não é conhecido, entretanto é importante assinalar que os receptores inibitórios que reconhecerem o HLA existente em suas células podem ter um papel positivo na maturação da célula NK, dando licença para matar29.
Em resumo, o balanço entre inibição e ativação faz com que a célula NK possa auxiliar o organismo na vigilância imunológica natural, mesmo antes da participação da imunidade adquirida. Os agentes infecciosos são eliminados ou parcialmente destruídos pela ação das células NK. Alem disso, outras patologias existem onde esse sistema tem igualmente importância, como certas doenças auto-imunes, tumorais, pré-eclâmpsia e abortos espontâneos recorrentes. Existem sugestões de que KIR ativadores possam reconhecer moléculas HLA de classe I que contenham peptídeos relacionados com algumas patologias ou mesmo outros tipos de ligantes que servem para identificar células anormais.
HIV
A imunidade adaptativa e inata tem importância em diversos estágios da infecção pelo HIV, inclusive em sua progressão. Elas são positivamente importantes na defesa contra a infecção aguda, podendo inclusive limitar a progressão da doença.
As células NK podem lisar, in vitro, células alvo infectadas com HIV, sendo que defeitos na função das células NK levam à progressão da doença. É conhecido que o HIV diminui a expressão do HLA e isso faz com que as células NK fiquem ativadas para lise das células alvo. Entretanto, também é de conhecimento que o vírus diminui a expressão das moléculas HLA-A e B, mas pode manter a expressão do HLA-C, auxiliando a evasão do reconhecimento pelas NK30.
A análise dos alelos HLA-B em indivíduos infectados demonstrou que a presença de homozigose para o HLA-Bw4, ligante do KIR3DL1 e supostamente do KIR3DS1 está associada com um declínio lento da contagem de linfócitos T CD4+, célula que possibilita conhecer a progressão da infecção31. Além disso, a análise de mais de 1000 indivíduos infectados com HIV demonstrou que aqueles com o genótipo KIR3DS1 e um subtipo do alelo HLA-Bw4 que apresenta isoleucina na posição 80 da cadeia pesada (Bw4Ile80), progridem mais lentamente daqueles onde a combinação KIR/HLA ativadora está ausente. Na realidade, o KIR3DS1 na ausência do específico Bw4 não é protetor, necessitando o sinergismo entre as duas moléculas para a obtenção do efeito benéfico. De toda maneira, a presença de um programa ativador das NK parece ser benéfica em limitar ou atrasar o início da doença. É sugerido que o receptor da célula NK (KIR3DS1) interage com o HLA-B Bw4-Ile80 que contém peptídeos do HIV, ativando as células NK para a eliminação da célula infectada. Na mesma população de pacientes infectados foi observado que a associação KIR3DS1/Bw4Ile80 apresentava risco retardado de infecções oportunísticas32.
Vários estudos tentam encontrar os motivos para que algumas profissionais do sexo não se tornem soropositivas. Embora não se tenha resposta adequada, parece claro que a imunogenética, traduzida na habilidade do bloqueio da entrada do HIV e respectiva soro conversão, não deve ser a mesma que realiza o controle da progressão da doença. No estudo realizado em Abidjan, Cote d’Ivoire demonstrou que as profissionais expostas e soro- negativas apresentavam freqüentemente genes KIR inibidores na ausência de seus genes HLA cognatos, estimulando à ativação da célula NK com correspondente proteção à progressão da doença. As mulheres expostas e soronegativas possuíam também, com maior freqüência, genótipos KIR com mais receptores ativadores33.
Hepatite C
Os indivíduos com HCV são 170 milhões e podem ficar curados ou cronicamente infectados. Esses últimos apresentam anticorpos anti-HCV e HCV-RNA circulantes e podem desenvolver cirrose e hepatoma. Os pacientes considerados curados são os que deixam de apresentar o genoma viral na circulação por dois anos.
Teoricamente, existe a hipótese de que uma resposta da imunidade inata pelas células NK possa estimular à maturação das células dendríticas. Essas, por sua vez, ativariam à resposta imune adaptativa por parte de linfócitos T, que possibilitariam ataque efetivo contra células infectadas com o vírus HCV. Ficou demonstrado que o grupo que obteve resolução de seu estado infeccioso tinha alta freqüência de homozigose para o HLA-C do grupo 1 e também homozigose para o KIR2DL3. A afinidade de ligação desse alelo pelo HLA-C é menor do que a do KIR2DL2 ou do KIR2DL1 para seus ligantes. Esses achados implicam num efeito benéfico da inibição, permitindo maior possibilidade de estimulação por receptores ativadores. Os pacientes com menor inoculação de vírus são também beneficiados com essa combinação de homozigose27.
Os resultados acima incentivam o pensamento da existência de um modelo quantitativo de programação das células NK de acordo com diferenças funcionais entre heterozigose e homozigose, tanto para os genes KIR como para os seus ligantes HLA. O aumento da inibição favorece a ativação e pode trazer beneficio ao paciente.
A importância das células NK no Transplante de Medula Óssea
A reatividade imunológica após o transplante de medula óssea é importante. Para diminuir a possibilidade de rejeição, realiza-se a mielo-ablação, ou seja, a destruição da medula óssea do paciente por quimioterapia. Esse procedimento possibilita à destruição do tecido linfóide do paciente, de suas células tumorais leucêmicas e permite espaço para a medula transplantada. A doença enxerto contra hospedeiro (graft versus host disease ou GVHD) é esperada em grande parte dos casos, sendo ocasionada pelos linfócitos T CD8 do doador que agridem especialmente o intestino, a pele e o fígado do paciente. Ela acontece após uma “tempestade” de linfocinas decorrentes da destruição mielo-ablativa, dependendo também da disparidade HLA entre doador e receptor. Dessa maneira, o ideal seria transplantarmos pacientes com medula óssea depletada de linfócitos T, diminuindo o risco de GVHD e uma discreta incompatibilidade HLA de classe I. Essa pequena disparidade ou aloreatividade serve para estimularmos as células NK e linfócitos T CD8 do doador a realizarem uma varredura na medula óssea do paciente, eliminando células leucêmicas remanescentes (graft versus leukemia ou GVL) e tecido medular residual. Entre as vantagens da discreta aloreatividade citamos a recuperação imunológica mais rápida, a redução de recidivas e a diminuição da quimioterapia mieloablativa34.
Nos transplantes sem depleção linfocitária do enxerto, a presença de KIR ativador no doador promove reatividade imunológica, enquanto no receptor induz tolerância.
Um aumento da GVHD aguda foi identificado com doador KIR2DS3 em transplantes com doador não relacionado, mas HLA idêntico e em casos onde o doador tinha mais de quatro KIR ativadores em transplantes haploidênticos.
Com intuito de simplificar as análises de efetividade, autores agruparam os pacientes em haplótipos A e B, sendo que os primeiros têm mais genes KIR inibidores e os segundos mais ativadores, assim como observar se os ligantes HLA-C1 e C2 serviriam para também avaliar a melhor compatibilidade KIR-HLA nos transplantes de medula óssea em pacientes com leucemia34. Em relação aos haplótipos A e B, examinaram a relação doador-receptor, sendo que o grupo homozigoto AA (com maior número de genes inibidores) foi considerado quando somente genes do grupo A estavam presentes. Todos os demais indivíduos tinham um ou mais genes específicos dos haplótipos B. Esses poderiam ser heterozigotos AB ou homozigotos BB, apresentando sempre genes KIR estimuladores. Aproximadamente 28% e 30% dos doadores e receptores, respectivamente, apresentaram o haplótipo AA, sendo que os demais tinham no mínimo um haplótipo B. A análise de sobrevida de 202 pacientes mostrou uma discreta e não significante tendência a menor sobrevida dos pacientes AA recebendo enxertos BX. Entretanto, em 113 pacientes com leucemia mielóide, um efeito benéfico foi demonstrado quando pacientes BX recebiam enxertos de doadores AA. Ao contrário a sobrevida foi 3,8 vezes pior nos pacientes AA que receberam enxertos de BX (p=0.046). Sendo assim, haplótipos B (mais genes estimuladores) no doador são prejudiciais nesse tipo de transplante, sendo que sua presença no receptor pode ser benéfica. Esses achados foram analisados e demonstraram independência em relação à idade do paciente e ao estágio da doença35.
A combinação de doador BX e receptor AA foi considerada fator de risco para a recidiva da doença (leucemia mielóide) e para a GVHD aguda grau II-IV. Em 112 pacientes transplantados, a incidência de GVHD aguda foi de 46% em receptores AA com doadores BX; 10% para receptores AA com doadores AA; 20% para receptores BX com doadores AA; 30% para receptores e doadores BX. Receptores AA, recebendo enxertos de doadores BX tiveram 5,8 vezes mais GVHD aguda do que os receptores AA que receberam enxertos AA (p=0.04).
Os ligantes mais dominantes para os receptores KIR são as moléculas de HLA-C. A diferença entre os ligantes C1 e C2 é que C2 produz uma inibição mais forte do que C1. Dessa maneira o mesmo estudo dividiu os pacientes transplantados de acordo com os dois grupos onde os receptores e seus doadores HLA idênticos eram C2. Receptores sem alelos pertencentes a C2 foram considerados C1 homozigotos (C1C1). Receptores com alelos para C2, incluindo C2 homozigotos foram denominados C2CX. Surpreendentemente, a combinação de doador BX e receptor AA foi identificada como fator de risco para GVHD aguda somente em transplantes C1C1 e não em C2CX. Quando foi examinada somente a relação do tipo de HLA-C, existiu uma leve tendência de fator de risco para GVHD em casos de C1C1, ao contrário de C2C2. A combinação do HLA-C com cada haplótipo KIR do doador e receptor demonstrou que receptores AA/C1C1 tiveram um fator de risco semelhante aos AA/C2X para a GVHD. Uma similar leve tendência foi identificada para os doadores BX/C1C1.
De acordo com a correlação observada, os autores procuraram estender a análise para o loco HLA-B, no qual o epítopo Bw4 é ligante mais forte para o inibidor KIR3DL1 do que o BW6. Nesses casos, a doença GVH aguda foi mais prevalente nos Bw4 positivos. Logo, a correlação para HLA-B é o oposto do observado para o HLA-C. A inibição pelo HLA-C parece vantajosa, enquanto a forte inibição pelo HLA-B (Bw4) é desvantajosa, sinalizando diferenças nos mecanismos existentes. Isto pode ser observado pelo fato de que o Bw4 não modifica o efeito da combinação de doador BX e receptor AA, enquanto C2 interfere. Uma possibilidade baseada em mecanismos conhecidos é de que C2 tem o efeito de inibir os linfócitos T que causam a GVHD, enquanto Bw4 inibe os linfócitos T aloreativos e as células NK que suprimem a mesma doença35.
Em resumo, a melhor sobrevida de transplantados por leucemia mielóide está associada com a presença KIR do grupo B no receptor e sua falta no doador. A pior sobrevida acontece quando o doador tem o grupo B e o receptor não. Essa última combinação está também associada com aumento de rescidiva e de GVHD aguda. Entretanto, esses efeitos deletérios foram vistos somente quando doador e receptor são homozigotos para o ligante KIR-C1. A presença do ligante Bw4 está associada com aumento de GVHD. A análise individual do KIR demonstra que o KIR2DS3 é fator protetor para a GVHD crônica.
Auto-imunidade
Diversos mecanismos tentam explicar a participação das células NK na auto-imunidade, entre eles, encontramos que os genótipos KIR/HLA que fazem a sintonia em favor da ativação podem ser vantajosos, tanto na eliminação de patógenos, como na predisposição à auto-imunidade. A inapropriada ativação pode ser responsável pela função patogênica. A ação supressora pode também ser prejudicial pela ativação de linfócitos T.
A esclerodermia é uma doença com fibrose tecidual, inflamação e injúria vascular quando existir a associação de KIR2DS2, ativador da célula NK, na ausência de seu correspondente inibidor KIR2DL236. Um interessante exemplo desse efeito é também encontrado na artrite psoriática, onde o KIR2DS1 e/ou KIR2DS2 tornam-se um forte risco para a doença quando os receptores inibidores KIR2DL1 e KIR2DL2/3 estiverem ausentes. Uma recente proposta sugere um modelo de susceptibilidade para essa doença pela presença de homozigose para ligantes HLA-C, minimizando sinais inibidores e conferindo forte ativação37.
Um cenário semelhante foi identificado para a vasculite reumatóide, onde o risco está associado com a presença do KIR2DS2. De maneira semelhante, a diabetes do tipo I está associada com aumento do KIR2DS2/HLA ligantes na presença de interações inibitórias. Os autores sugerem um modelo onde a função KIR promova mais ativação de baixa afinidade para os linfócitos T responsáveis pela auto-imunidade38.
A psoríase vulgar (PV) é uma doença crônica e inflamatória da pele, cuja patogênese e influência genética permanecem pouco esclarecidas. Estudos anteriores sugerem uma associação entre essa patologia com os receptores KIR2DS1 e com o HLA-C0602, sendo que os indivíduos que apresentam esse último alelo têm 10 vezes mais chances de vir a ter PV. Em nossa população caucasóide analisada encontramos o alelo Cw0602 em 26,5% dos pacientes com PV, contra somente 5,4% dos controles (p<0,001).
Em relação ao gene ativador KIR2DS1 diversas publicações identificaram-no estatisticamente mais prevalente nos pacientes em comparação com os controles39. Outros estudos pretendem demonstrar que a PV é uma doença onde esses receptores KIR ativadores estão presentes na ausência de seus ligantes HLA homólogos. Dessa maneira a PV é decorrente, além de outros fatores ambientais, de um balanço de genótipos ativadores e inibidores com predominância dos ativadores40.
Conclusão
A intenção desse artigo é transmitir conhecimentos atuais sobre a Imunidade Inata e sua relação com a vigilância imunológica dos pacientes. A importância para a Pediatria pode ser antecipada nos pacientes prematuros, recém nascidos e para todos que não tenham desenvolvido uma imunidade adquirida sólida. As células NK, seus receptores e genes fazem parte da manutenção da saúde especialmente nessa época da vida, quando a imunidade adquirida ainda não é efetiva. Esse conjunto de genes e receptores são parceiros dos pediatras, quando preferem esperar a recuperação, antes de lançar mão de antibióticos precocemente no início de uma infecção. É durante esse período de espera da recuperação que os mecanismos inatos participam e, na maioria das vezes, conseguem vencer os agentes infecciosos. No decorrer dessa revisão, podemos encontrar as bases imunogenéticas da existência desse sistema recentemente identificado como de importância na prevenção infecciosa.
